郑州试剂盒CE认证费用
- ¥1000.00
- 2022-08-26 04:03:59
- CE认证
- 张丽娟 13590198151
- 航天检测技术(深圳)有限公司
信息介绍
详细参数
自测版试剂盒CE认证和目前欧盟各成员国推出的“白名单”政策有什么区别?
答:按照欧盟法规要求,自测版试剂盒出口欧盟需取得公告机构颁发的CE认证方可在欧盟市场流通销售,但由于目前自测版试剂盒办理CE认证的周期相对较长,市面上已获得自测版试剂盒CE认证的制造商也并不多。加上欧盟部分国家为了防控,推行居家自测的检测方式,因此欧盟部分成员国便推出了“白名单政策”,即只要相关企业通过了该国白名单的申请和审核,在未取得CE认证的情况下,短期下允许相关企业可按自测版试剂盒在市面通销售。但需要注意的是,白名单政策仅是临时性的政策,存在较大的不确定性。
自测版试剂盒办理CE认证的周期多长?
目前公告机构的发证周期一般是3-6个月,如制造商的技术文件比较完整和的话,有可能可提前完成。(我们可提供加急服务,质地的企业,少量名额。)
自测版试剂盒CE认证的证书有效期是多久?
答:现办理下证后的CE证书可使用至2024年5月份。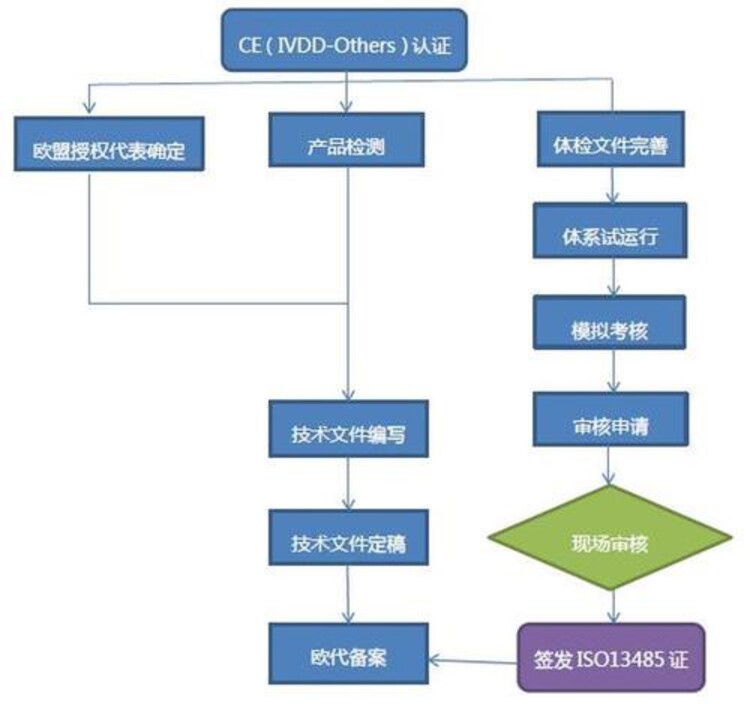
办理自测版试剂盒CE认证时,对于产品的性能评估要求是什么?
答:阴性、阳性各200例以上、灵敏度指标≥ 90%、特异性指标≥ 98%、数据来源须真实有效,出具数据或报告的机构须具备相关资质,仅提供企业自身编写的总结报告不受认可,还需提供原始数据和报告。
体外诊断产品(IVDD)认证知识介绍:
在医疗器械领域,欧盟制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。指令分别是:主动植入式医疗器材(AIMD 90/385/EEC)/医疗器材(MDD 93/42/EEC)/体外诊断医疗器材(IVDD 98/79/EC)。
我国医疗器械生产企业及出口公司在将其产品销往欧盟市场时,符合上述指令规定,加贴CE标志,否则产品难以进入欧盟市场。由于我国在这方面宣传力度不够,虽然上述三个指令中的AIMD已强制实施多年,IVD也于1999年强制实施,但目前还有众多的医疗器械生产厂家及出口公司对这些要求不甚了解,因此今年我国的医疗器械出口将面临严峻的考验。
新型冠状病毒荧光PCR检测试剂盒 、新型冠状病毒、甲型流感病毒、乙型流感病毒三重荧光PCR检测试剂盒、肠道冠状病毒荧光PCR检测试剂盒 、植绒拭子及裂解型采样管套装 、采样拭子、采样器、口罩、隔离衣、防护服、手术衣医用帽子鞋套出口欧美,我司为您提供**服务,助您快速进入欧盟市场,
1.编写MDD、MDR、IVDD CE技术文档;
2.符合性声明DOC;
3.欧盟授权代表;
4.申请欧盟CIBG注册
5.欧盟自由销售证书办理
6.FDA注册、美国代理人、FDA510K申报
- CE认证
- CE认证
- 张丽娟
试剂盒CE认证信息
-
 威海霍尔传感器价格,防雷器避雷器面议
威海霍尔传感器价格,防雷器避雷器面议 -
 实用王义红木大红酸枝沙发艺传千年面议
实用王义红木大红酸枝沙发艺传千年面议 -
 天津长途救护车安全及时面议
天津长途救护车安全及时面议 -
 浙江从事皂角树苗木多少钱¥ 200
浙江从事皂角树苗木多少钱¥ 200 -
 水唇镇伸缩动臂抓斗租赁价格面议
水唇镇伸缩动臂抓斗租赁价格面议 -
 1949年红工厂壹佰元没想到回收价格这么高面议
1949年红工厂壹佰元没想到回收价格这么高面议











